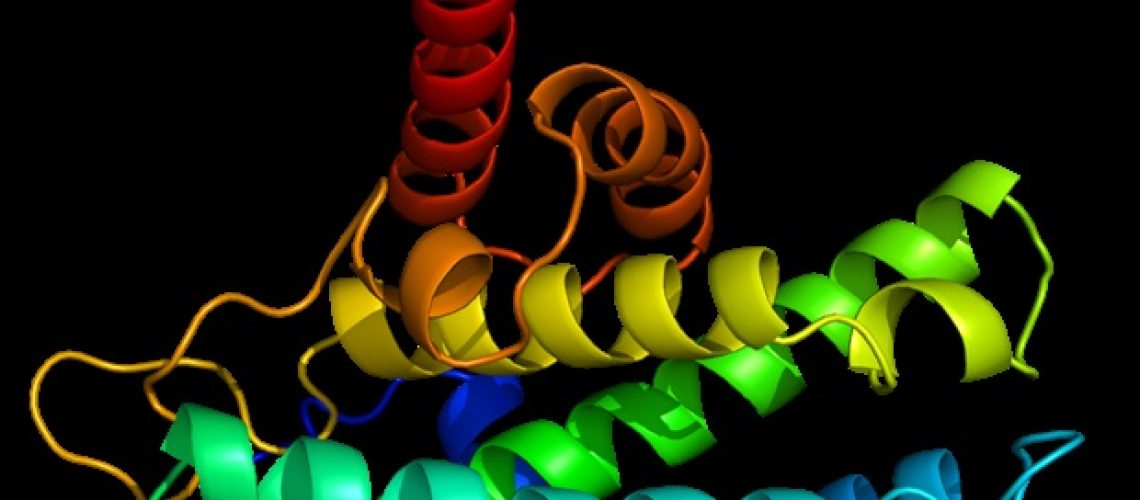
"תמונת מצב" מולקולרית של חלבון יכולה להיות קריטית להבנת תפקידו. מדענים בסטנפורד וב-NYU פרסמו וחקרו מבנה חדש של החלבון LAG-3 שיכול לאפשר פיתוח טיפולי סרטן חדשים.
חלק מהגידולים הסרטניים חוטפים חלבונים הפועלים כ"בלמים" על מערכת החיסון שלנו ומשתמשים בהם כדי ליצור מעין מגן מפני זיהוי חיסוני. נוצרו טיפולי אימונותרפיה שמכבים את ה"בלמים" הללו ומאפשרים לגופנו לתקוף תאים סרטניים בעלי מראה זר. כדי להמשיך ולקדם טיפולים כאלה, חוקרים מאוניברסיטת סטנפורד ואוניברסיטת ניו יורק פרסמו מבנה חדש של אחד מחלבוני הבלמים הללו, LAG-3. עבודתם מכילה פרטים מרכזיים על מבנה המולקולה, כמו גם מידע על אופן פעולת החלבון LAG-3.
למרות שלמעלה מתריסר טיפולים אימונותרפיים המכוונים ל-LAG-3 נמצאים בפיתוח, ואחד כבר אושר על ידי ה-FDA, הידע על המבנה והתפקוד של LAG-3 לא היה שלם.
"בהתחשב בכמות הזמן והמשאבים המושקעים בפיתוח תרופות המכוונות ל-LAG-3, מדהים שעדיין אין לנו הבנה מלאה של אופן פעולת החלבון הזה", אמרה ג'ניפר קוקרן, הפרופסור של אדי ואל מקובסקי ב בית הספר להנדסה ופרופסור לביו-הנדסה, ומחבר בכיר במחקר המפרט את LAG-3, שפורסם ב- הליכים של האקדמיה הלאומית למדעים.
קבלת תמונה ברורה של חלבון אולי לא נראית כמו עניין גדול, אבל כשזה מגיע לחלבונים, צורה לעתים קרובות מולידה תפקוד. אם אתה יודע איך חלבון נראה בקנה מידה אטומי, אתה יכול להתחיל להבין כיצד הוא מקיים אינטראקציה עם מולקולות אחרות ולתכנן ניסויים כדי להסיק כיצד הוא פועל. מחקרים כאלה חיוניים לפיתוח תרופות שיכולות לחסום בצורה מיטבית את תפקוד המטרה שלהן.
מבנה מפתח
חלבונים כמו LAG-3, הנקראים מחסומים חיסוניים, קיימים כדי למנוע מהמערכת החיסונית שלנו לתקוף דברים שהם לא צריכים. בתיאוריה, מערכת החיסון שלנו צריכה לזהות באופן טבעי תאי גידול כזרים. אבל מגן חלבון מחסום יכול לתת כיסוי לסרטן.
האימונותרפיות הנוכחיות אינן תרופות כימיות, הן נוגדנים שיוצרו במעבדה, הנצמדים לחלקים מסוימים של המחסומים הללו, ובעצם מכבים אותם. לאחר כיבוי המחסום, המערכת החיסונית שלנו יכולה לזהות ולמקד שוב את הסרטן.
ישנם כבר טיפולי נוגדנים מאושרים המכוונים לשני חלבוני מחסום: CTLA-4 ו-PD-1. שניהם מכבים את מערכת החיסון שלנו אבל בדרכים שונות. מכיוון ש-CTLA-4 ו-PD-1 היו שני חלבוני המחסום הראשונים שנמצאו, הם נחקרו היטב, וגישות שונות לעיכובם לטיפול בסרטן זיכו את המדענים בפרס נובל לפיזיולוגיה או רפואה לשנת 2018.
נראה ש-LAG-3 עובד בצורה אחרת לגמרי. מדענים מקווים שההבדלים הללו עשויים להפוך אותו למטרה טובה יותר או משלימה לטיפול בסוגים מסוימים של סרטן, אמר ג'ק זילברשטיין, הדוקטורנט לאימונולוגיה בסטנפורד שהוביל את העבודה.
בגלל זה, אמר זילברשטיין, "הייתה כל ההתרגשות הזו בשטח. קבוצות מיהרו לייצר נוגדנים נגד LAG-3, מבלי לדעת לגמרי איך LAG-3 או אותם נוגדנים פועלים".
זילברשטיין ועמיתיו, כולל אלו במרכז הידע של מבנה מקרומולקולרי של סטנפורד ChEM-H ובמעבדת המאיץ הלאומית של SLAC, החלו לעבוד על המבנה של LAG-3 בשנת 2019. מבנה של LAG-3 פורסם על ידי קבוצה אחרת בשנת 2022 ומספק הצצה ראשונית של החלבון, אבל הוא חסר פרטים מכריעים סביב מולקולות סוכר שהן מפתח לתפקוד של LAG-3, ומידע מפורט על האופן שבו מבנה LAG-3 קשור לפעילותו הביולוגית.
תהליך קפדני
כשזילברשטיין התחיל את הפרויקט הזה, "הבנתי מהר מאוד למה לא היה מבנה פורסם. זה חלבון שקשה מאוד לעבוד איתו".
והטכניקה שבה השתמש זילברשטיין כדי לקבל את המבנה, הנקראת קריסטלוגרפיה של קרני רנטגן, היא קפדנית ביותר. ראשית, היה על זילברשטיין לגדל גביש העשוי כולו מחלבון LAG-3. לאחר מכן, בשיתוף פעולה עם Irimpan Mathews במעבדת האצה הלאומית של SLAC, הם ירו קרני רנטגן לעבר הגביש כדי ליצור תמונה תלת מימדית של המולקולה.
LAG-3 הוא חלבון דק וגמיש, ולכן קשה לגרום למולקולות להיערם בצורה מסודרת. זילברשטיין מעריך שהוא יצר יותר מ-10,000 גבישים, מתוכם 3,000 נורו בקרני רנטגן לפני שהצוות פתר לבסוף את המבנה.
זה היה דבר מאוד אינטנסיבי, לטחון-זה-לאורך-שלוש שנים, לדפוק את הראש-בקיר".
ג'ק זילברשטיין, דוקטורנט לאימונולוגיה בסטנפורד
אבל זה השתלם. המבנה של הצוות אישר כי LAG-3 קיים כדימר, כאשר שתי מולקולות LAG-3 מתחברות יחד ליצירת חלבון המחסום הפונקציונלי. שאריות הסוכר שהיו חמקמקות במאמצים מבניים קודמים היא מרכיב מרכזי בממשק ה-LAG-3 dimer ועוזרת לקדם אוריינטציה שונה של חלבון LAG-3.
עם המבנה המתואר, עמיתים מאוניברסיטת ניו יורק, כולל MD, דוקטורנט ג'ספר דו ועוזר פרופסור לפתולוגיה ג'ון וואנג הובילו יחד ניסויים קריטיים שהבהירו עוד יותר את תפקוד LAG-3. עמיתים אחרים של NYU, כולל Kun-Wei Chan ו-Xiang-Peng Kong, עזרו לערוך מחקרים במיקרוסקופ אלקטרונים כדי לפרט את ההפרעה ביצירת דימר על ידי נוגדני LAG-3.
עבודה נוספת של הצוות גילתה, לראשונה, כי נוגדן שנמצא בשימוש קרוב ל-20 שנה להדגמת יעילות טיפולית במודלים של גידולים בבעלי חיים חוסם את הפעילות של LAG-3 על ידי קישור לממשק בין שתי מולקולות LAG-3 , משבש את LAG-3 מיצירת הדימר הפונקציונלי שלו. באופן מסקרן, נוגדני LAG-3 בפיתוח קליני נקשרים לאזורים אחרים של החלבון, הרחק מממשק הדימר הזה.
לעולם לא תהיה רק "תרופה" אחת, מכיוון שסוגי הסרטן כולם שונים וכוללים מספר מסלולים ביוכימיים מגוונים. זילברשטיין וקוקרן חוזים עתיד שבו נעשה שימוש בגוון של גישות טיפול כירורגי, כימי ואימונולוגי, המונע על ידי גילויים מדעיים בסיסיים וחידושים רפואיים. טיפולים נוספים המכוונים ל-LAG-3 עשויים בהחלט להיות חלק מהתמונה הזו.